Хелатные микроэлементы Хелатэм™, как элемент прогрессивной технологии питания растений | «Буйский химический завод»





Хелатные микроэлементы Хелатэм™,
как элемент прогрессивной технологии питания растений
Начальник отдела маркетинга ОАО «Буйский химический завод»
Белозёров Д.А.
ОАО «Буйский химический завод» имеет в своем ассортименте широкий спектр водорастворимых минеральных удобрений, предназначенных для различных технологий питания культур в защищенном грунте. Это сульфатная группа – сульфат калия, сульфат магния, нитратная группа – нитрат кальция, нитрат магния, нитрат калия, монокалийфосфат, микроэлементы в сульфатной и хелатной форме, микроэлементные комплексы и комплексы на основе NPK+микроэлементы. С 2019 года наше предприятие расширяет спектр удобрений для тепличных комбинатов такими востребованными позициями, как хлористый кальций весом по 20 кг. и кислота – азотная, ортофосфорная, серная в емкостях по 20 литров.
В данной статье мы подробнее рассмотрим линейку хелатных микроэлементов, производимых под торговым названием ХелатэмТМ.
Начиная с 2000-х годов, ОАО «БХЗ» начал разрабатывать и производить более технологичные водорастворимые комплексные удобрения «Акварин», чем существующий на тот период «Растворин». Новые системы полива, в том числе и капельный, требовали высокой степени растворения и наименьшего нерастворимого остатка или его отсутствие. Сульфатные формы микроэлементов не позволяли этого сделать. Выход был найден благодаря введению в удобрительные комплексы высококачественных хелатных микроэлементов. На тот период в Российской Федерации не было производителей подобных удобрений, поэтому мы сотрудничали с иностранными компаниями Валагро (Италия), Пуччиони (Италия), Лима (Бельгия).
На протяжении долгих лет завод обеспечивал тепличные комбинаты хелатированными металлами импортного производства, делал собственные комплексные микроудобрения – «скорую помощь» при хлорозах «Аквамикс», удобрения для некорневых подкормок и капельного орошения «Акварин». До тех пор, пока, потребляемые нами выросшие объемы микроэлементов, не стали вызывать логистические проблемы, сбои в поставках от наших партнеров.
Руководством предприятия было принято решение о необходимости собственного производства и в 2015 году осуществлен запуск цеха хелатных микроэлементов.
Сегодня мы производим и поставляем нашим потребителям все основные хелаты металлов, которые используются в защищенном грунте.
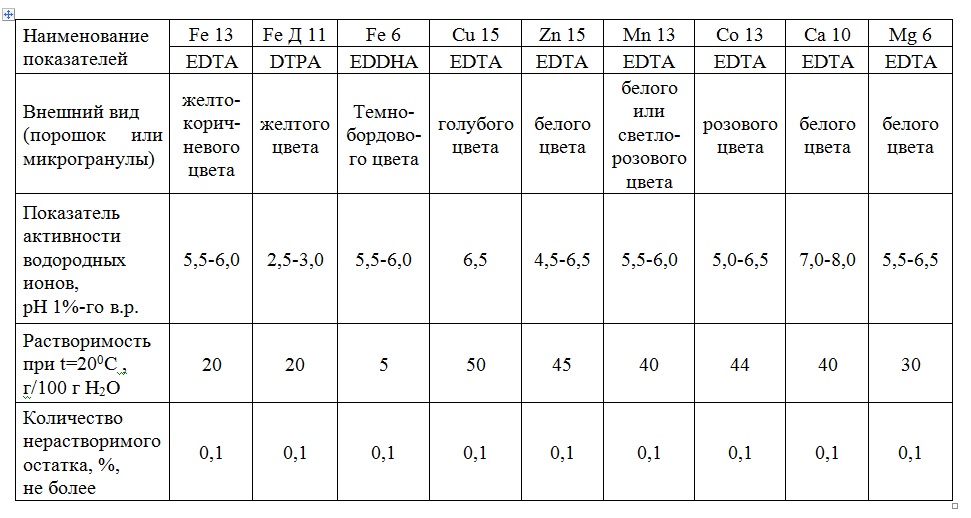
Таблица 1
Технологии выращивания овощей, зеленных, цветочно-декоративных культур подразумевают приготовление питательных растворов (маточных) в определенном диапазоне рН. Обычно это 5,5-6,5. То же требование относится и к рН внутри субстратов (минеральная вата, кокосовый субстрат и др.).
Обычно, забор воды происходит либо с водопровода – ЕС в пределах 0,3-0,8 мСм/см, рН>6,5, либо своих собственных скважин – ЕС может достигать 1,5-1,7 мСм/см, а рН>7,0-9,0. То есть обязательно должна проводиться предварительная подготовка воды – очистка от примесей, выравнивание рН.
Но что происходит на практике?
Во-первых, даже если водоподготовка была сделана, в виду изменения климатических условий внутри теплицы, реакции растений на внешние раздражители, переувлажнение, недоувлажнение и прочее приводит к частым колебаниям рН среды субстрата, выходящими за пределы 5,5-6,5 в ту или иную сторону. Элементы питания по разному реагируют на более кислую или щелочную среду. Фосфор и микроэлементы чаще всего в щелочной среде становятся менее эффективными, а если в растворе присутствуют карбонаты (бикарбонаты), то могут образовать нерастворимые соединения, выпадающие в осадок.
Во-вторых, часть тепличных комбинатов не занимаются серьезно водоподготовкой, либо делают её по-своему. Сначала готовят маточные растворы, а потом измеряют рН и доводят его до нужной величины, подкисляя азотной кислотой. В этой последовательности действий кроется главная ошибка! Если мы не провели водоподготовку, в особенности скважинной воды, в маточном (концентрированном) растворе плохо растворяются такие минеральные соли, как сульфат калия, монокалийфосфат, кальций и/или происходят химические реакции между внесенными по рецептуре удобрениями и карбонатами (бикарбонатами). Далее все происходит так же, как и в первом случае.
Для чистоты эксперимента мы смоделировали данную ситуацию в экспериментальной теплице, которую ОАО «Буйский химический завод» в 2018 году построил на своей территории для проведения опытов. В ней проводятся испытания в управляемых условиях новых видов удобрений собственного производства, конкурентных удобрений, поиск новых перспективных направлений в удобрении растениеводческой продукции.
При подаче технической воды для полива мы не проводили специальной водоподготовки: рН-7,5, ЕС-0,4 мСм/см. В итоге наблюдали массовое проявление хлороза – осветление межпрожилочного пространства нижнего яруса листьев испытуемых растений, как результат действия слабощелочной среды.
Применяя в системе полива хелатные микроэлементы, проблему хлороза удалось устранить. На среднем и верхнем ярусе листьев хлорозов не наблюдается.
В чем же преимущество хелатных соединений, относительно сульфатных? В растения элементы питания попадают только в виде ионов и катионов. Рассмотрим механизм усвоения элемента – железа. Молекула сульфат железа попадая в раствор распадается на катион железа Fe2+ и ион кислотного остатка (SO4)2-. Железо, находясь в свободном состоянии в маточном растворе, легко образовывает новые соединения. Тем более, если в растворе присутствуют карбонаты (бикарбонаты), то велика вероятность образования карбоната железа – нерастворимого соединения. Железо становится недоступным для растений элементом. То же происходит и с другими сульфатами металлов.
Хелат железа имеет более сложную структуру. Железо прочно связано двух- либо трёхковалентной связью, в зависимости от вида органической кислоты. Когда такое вещество попадает в маточный раствор, то молекула делится на катион водорода Н+ (либо натрия Na+) и ион кислотного остатка, внутри которого также прочно продолжает «сидеть» железо. В таком связанном виде оно доставляется в растение, где используется в полном объеме без потерь.
Производство хелатных удобрений сложный процесс. Требует специального оборудования и методов анализа в процессе синтеза новых соединений и готовой продукции. Наш потребитель должен быть уверен в качестве получаемой продукции.
Инженерами-исследователями Центральной заводской лаборатории Буйского химического завода были разработаны и внедрены в производство ряд методик по качественному, количественному анализу и определению диапазона устойчивости хелатных соединений.
фото 5. Центральная заводская лаборатория, HITACHI Cromaster
Так, например, был разработан способ определения хелатированного железа методом высокоэффективной жидкостной хромотографии (ВЭЖХ), апробирован и утвержден специалистами химического факультета МГУ г.Москва. Данная методика позволяет провести градуировку прибора HITACHI Cromaster сразу на два стандарта железа EDTA и DTPA, что существенно экономит время на последующее тестирование образцов.
На графике со стандартами (фото 7 и фото 8) видно в каком диапазоне времяудержания находится железо EDTA и DTPA. На графиках исследуемых образцов (цеховой образец, Китай, Valagro) по диапазону времяудержания определяется тот или иной вид хелата, а по площади области пика образца математическим методом вычисляется количество хелатированного элемента.
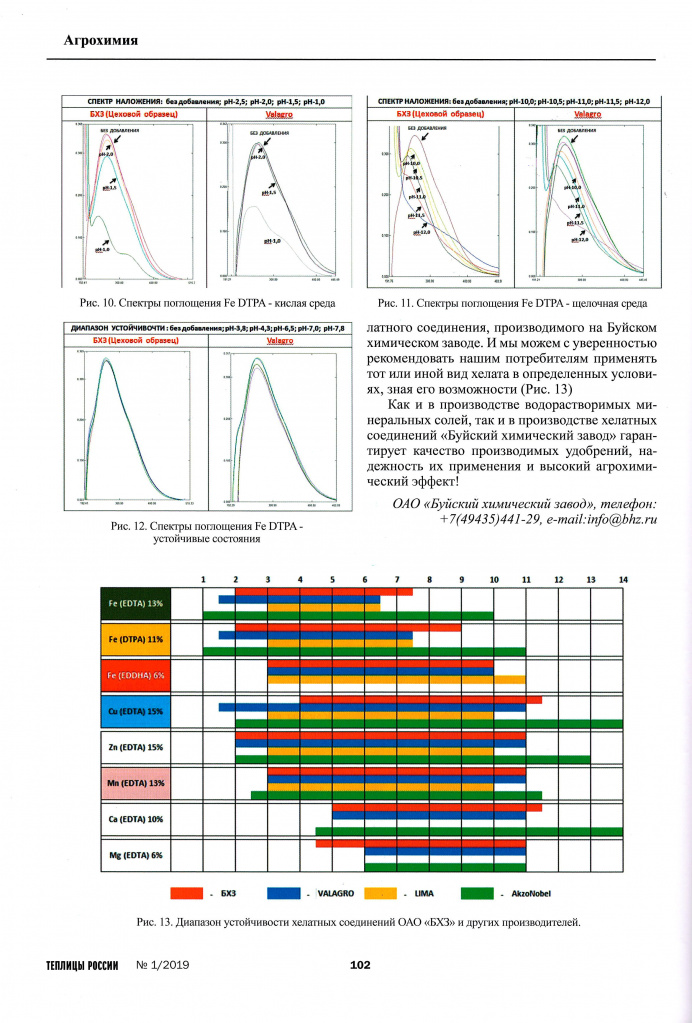
Следующей нашей задачей стояло определение диапазона устойчивости хелатного соединения в различных средах рН. Особенно важно знать состояние хелата в условиях выходящих за рамки предусмотренных технологией выращивания рН 5,5-6,5. Для этого специалистами завода был разработан спектрофотометрический метод определения диапазона устойчивости. Данный метод проходит апробацию в НИЦ «Курчатовский институт» (ИРЕА).
На Фото 10, 11, 12 представлены графики зависимости оптической плотности растворов от длины волны излучаемого спектра. За точку отсчета берем график поглощения при нормальном рН-6,0. Пик приходится на длину волны 260 нм, а исследуемая область графика на волне 290 нм.
Как мы видим из графиков на Фото 10 и Фото 11, при изменении среды в кислую (рН-2,5; рН-2,0; рН-1,5; рН-1,0) или щелочную (рН-10,0; рН-10,5; рН-11,0; рН-11,5; рН-12,0) сторону происходит изменение состояния вещества и изменение оптической плотности в следствие разрушения данного соединения. На Фото 12 приведены примеры устойчивых состояний хелата железа DTPA, например, при рН-3,8; рН-4,3; рН-6,5; рН-7,0; рН-7,8.
Таким образом, были выявлены диапазоны устойчивости в различных средах рН для каждого хелатного соединения, производимого на Буйском химическом заводе. И мы можем с уверенностью рекомендовать нашим потребителям применять тот или иной вид «Хелатэм» в определенных условиях, зная его возможности.
Как и в производстве водорастворимых минеральных солей, так и в производстве хелатных соединений «Буйский химический завод» гарантирует качество производимых удобрений, надежность их применения и высокий агрохимический эффект!
